BioArt按:G蛋白偶联受体(GPCR)是人体内最大的蛋白质家族(超过800个),在细胞信号转导中发挥非常关键的作用。根据其相似性分为A、B、C和F等四种类型。过去十多年间里,科学家通过X射线晶体衍射技术获得了不少GPCR的结构,如β2肾上腺素受体、A2A腺苷受体、趋化因子受体CCR5、嘌呤能受体P2Y1R、D3多巴胺受体、大麻受体等,都是靶向各种人类疾病的重要治疗靶点,然而上述受体都属于“A类”GPCR,这类受体蛋白的结构和序列特征较为常见,相对而言,“B类”GPCR更具有挑战性,其中就包括胰高血糖素受体。5月17日,上海科创中心建设核心区--张江高科技园区科研团队的多项G蛋白偶联受体(GPCR)重大科研成果集中亮相,包括两篇Nature 和一篇Nature Communication s研究论文。其中,由中科院上海药物研究所吴蓓丽、王明伟和蒋华良领衔的科研团队成功解析“B类”GPCR--人源胰高血糖素受体(GCGR)全长蛋白的三维结构,揭示了该受体蛋白不同结构域对其活化的调控机制;由上海科技大学iHuman研究所Raymond C. Stevens、复旦大学药学院王明伟、上海科技大学iHuman研究所刘志杰领衔的科研团队成功解析另一个“B类”GPCR--人源胰高血糖素样肽1受体(GLP-1R)的七次跨膜区晶体结构,揭示了其别构调节机理,上述两项成果同时在线发表在Nature 杂志上。此外,iHuman研究所徐菲、陶厚朝和复旦大学药学院谭文福领衔的科研团队成功解析了人源Smoothened(平滑)受体(F类)的多结构域三维结构,这项成果17日傍晚在Nature Communications 杂志上发表。复旦大学药学院是上述三项科研成果的主要合作单位。特别值得一提的是,上述两个重要“B类”GPCR的解析是在激烈的国际同行竞争之下完成的,上个月24号来自澳大利亚的一个科研团队使用冷冻电镜的方法解析了首个全长“B类”GPCR的结构(calcitonin receptor),不过本次中国科学家获得的GCGR晶体结构(3.0埃)和GLP-1R(2.7埃)其分辨率显著高于前者(4.1埃)。



论文解读:
G蛋白偶联受体(G protein-coupled receptor, GPCR)是人体内最大的蛋白质家族,由800多个成员组成,在细胞信号转导中发挥非常关键的作用。这类受体的共同点是其三维结构中都包含七个跨膜螺旋,而根据其相似性,GPCR可分为A、B、C和F等四种类型(下图)【1】。GPCR能接受细胞周围环境中的光信号或化学物质(如氨基酸、激素、神经递质和趋化因子等)与其结合所产生的信号,从而激活细胞内的一系列转导通路。GPCR与人类疾病关系密切,是最大的药物靶标蛋白家族,目前40%以上的上市药物以GPCR为靶点。
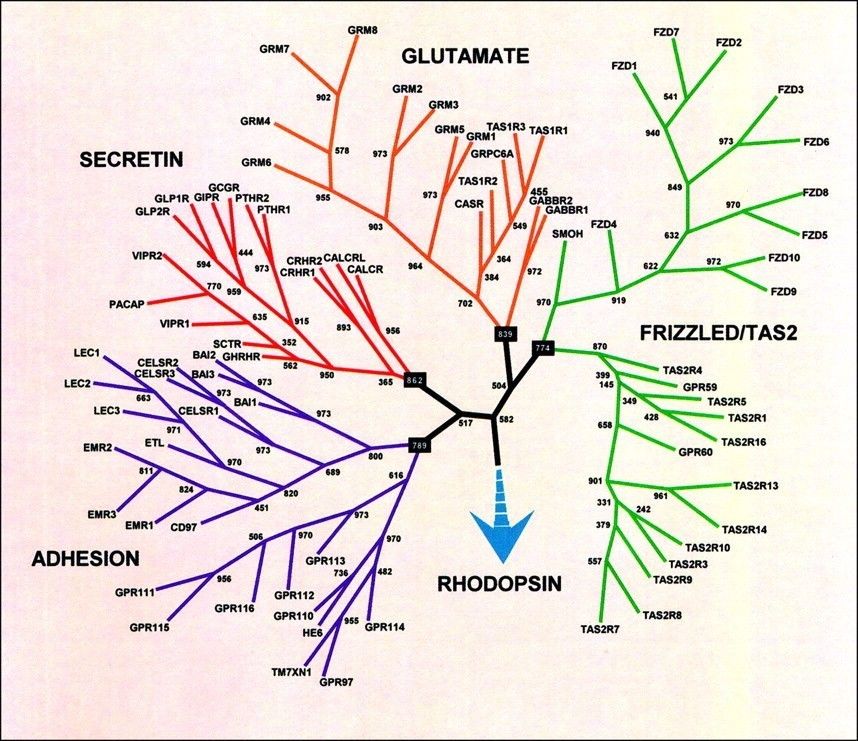
人类基因组中包含的GPCRs进化树示意图。图片引自:Fredriksson, R., Lagerstr?m, M. C., Lundin, L. G., & Schi?th, H. B. (2003). The G-protein-coupled receptors in the human genome form five main families. Phylogenetic analysis, paralogon groups, and Pharmacology,63(6), 1256-1272.
B型GPCR包括胰高血糖素受体(glucagon receptor, GCGR)和胰高血糖素样肽-1受体(glucagon-like peptide-1 receptor, GLP-1R)等15个成员。GCGR和GLP-1R是维持人体血糖平衡的两个重要“调节器”:在饥饿状态下,GCGR通过与其配体胰高血糖素(glucagon)结合来提高人体血糖水平;而GLP-1R主要在摄食后发挥作用,通过与其配体胰高血糖素样肽-1(glucagon-like peptide-1)结合,刺激胰岛素分泌,使餐后血糖降低并维持在正常水平。上述两个受体是人体血糖代谢的关键调节因素,如果想要开发的针对糖尿病的药物,获得高分辨率的相关结构则是非常关键的一环。
B型GPCR包括胞外结构域和跨膜结构域且两者共同参与识别细胞信号分子, 获得稳定和高质量的全长GCGR蛋白难度极大,这不仅限制了人们对GCGR与其天然配体和小分子拮抗剂相互作用机制的理解,也影响了靶向该受体的药物研发--目前尚无上市药物 上一篇:大数据助力可持续发展 中国科学院这份报告不简 下一篇:没有了